Обычная вода в трубах содержит разное количество примесей, концентрация которых делает воду более или менее жесткой. В качестве смягчителя используется соль таблетированная. Это недорогой, но эффективный способ снижения жесткости воды при обычных температурах и стандартном давлении в трубопроводе. В статье мастер сантехник расскажет, как действует таблетированная соль для фильтра и систем водоочистки.
Жесткая вода – смесь с высоким содержанием ионов кальция, магния. При термообработке часть ионов остается в осадке, а часть растворяется и попадает в организм человека. Высокая концентрация веществ плохо влияет на работу приборов, образуя осадок, в такой воде не мылится моющее средство, на посуде и вещах остается жирный налет.
Принцип действия таблеток хлорида натрия в замещении катионов жесткости на подвижные катионы натрия.
Свойство порошка известно давно, применялись специальные колбы-умягчители со смолой внутри. И сейчас ионообменные смолы с полимерами используются в фильтрах, колбы лишь выглядят более современно. Кроме того, фильтровальное оборудование приходится менять или восстанавливать смолу после вымывания всех ионов соли из натрия и соляной кислоты.
Умягчение воды методом натрий-катионирования
Технология умягчения воды на основе ионного обмена, а именно, на основе Натрий-катионирования основывается на химических реакциях обмена ионами – т.е. одни ионы (в нашем случае – ионы, формирующие жесткость воды – Кальций, Магний) извлекаются из воды, а взамен их в воду «добавляются» ионы замещения. В случае с использованием Na-катионирования такими «замещающими» ионами становятся ионы Натрия, не вызывающие эффекта «накипеобразования».
В виде набора химических реакций этот процесс можно выразить следующим образом:
- 2NaR+ Ca(HCO3)2 - CaR2 + 2NaHCO3– где гидрокарбонат кальция в процессе обмена преобразуется в гидрокарбонат Натрия с фиксацией ионов кальция в матрице ионообменного материала;
- 2NaR+ Mg(HCO3)2 - MgR2 + 2NaHCO3 – где гидрокарбонат магния в процессе обмена преобразуется в гидрокарбонат Натрия с фиксацией ионов магния в матрице ионообменного материала;
- 2NaR+ CaCl2 - CaR2 + 2NaCl– где аналогичным образом происходит замещение хлорида кальция на хлорид натрия;
- 2NaR+ MgSO4 - MgR2 + Na2SO4– где сульфат магния преобразуется в сульфат натрия;
- 2NaR + CaSiO3 - CaR2 + Na2SiO3– где силикат кальция преобразуется в силикат натрия.
R в контексте рассматриваемых химических реакций представляет собой комплекс катионита, упрощенно называемый анионитной частью катионита.
Уравнения обменных реакций с солями MgCl2, CaSO4 и MgSiO3 аналогичны приведенным уравнениям. Ионы, которые участвуют в реакциях обмена: Na+, с одной стороны, и Ca2+; Mg2+, с другой стороны, называются противоионами.
Реакции ионного обмена обратимы.
Это один из важнейших принципов, на которых строится работа фильтров – умягчителей, в которых используется ионообменный материал. Суть обратимости процесса лежит во многократной возможности протекания реакций замещения.
По мере пропускания воды через слой катионита количество ионов натрия, способных к обмену, уменьшается, а количество ионов кальция и магния, задержанных в матрице катионита, возрастает, то есть емкость катионита «истощается». Поэтому при возрастании в воде концентрации ионов натрия по сравнению с остающимся количеством ионов кальция и магния, процесс поглощения ионов Ca2+ и Mg2+ из воды замедляется, и равновесие реакций начинает сдвигаться в левую сторону. Это может привести к «проскоку» «сырой», не умягченной воды в фильтрат.
Чтобы этого избежать, следует провести регенерацию ионообменной смолы – пропустить через слой катионита реагент, который восстановит обменную емкость катионита – раствор хлорида натрия. На практике, раствор хлорида натрия, представляет собой насыщенный раствор пищевой (поваренной) или технической очищенной соли, с плотностью раствора, примерно равной 1,13.
Выбор хлорида натрия в качестве реагента для регенерации катионита процесса Na-катионирования не был случайным. Прежде всего, он привлекает своей доступностью и относительной дешевизной. Кроме того, основные продукты регенерации катионита (соединения, возникающие в процессе пропускания насыщенного раствора хлорида натрия через ионообменный материал) – это соли CaCl2, MgCl2, которые являются веществами, хорошо растворимыми в воде. Это их выгодно отличает, например, от СаСО3 (если бы регенерация проводилась карбонатом натрия (Na2CO3)) или CaSO4 (если бы регенерация проводилась сульфатом натрия (Na2SO4)).
Процесс регенерации катионита может быть представлен следующим образом:
- CaR2 + 2Na+ - 2 NaR + Ca2+- происходит процесс обратного замещения накопленных ионов кальция ионами натрия;
- MgR2 + 2Na+ - 2 NaR + Mg2+- аналогичный процесс замещения, происходящий с ионами магния.
Таким образом, технология ионного обмена для умягчения воды представляет собой двунаправленный процесс, где сначала осуществляется замещение ионов кальция и магния, содержащихся в сырой (исходной) воде на ионы натрия, содержащиеся в матрице катионита. Далее, во время регенерации, осуществляется обратный процесс замещения -«перезарядка катионита», а продукты регенерации в виде соединений хлоридов кальция и магния – вымываются вместе с регенерирующим раствором в дренаж. После регенерации фильтры-умягчители полностью восстанавливают свои свойства.
Учитывая эффективность и технологичность используемых НПП «Национальный центр водных технологий» ионообменных материалов, срок их службы составляет, в среднем, от 4 до 7 лет, после чего необходимо осуществить замену катионита.
Факторы, влияющие на эффективность работы технологии.
При построении систем умягчения воды важно понимать, что на эффективность работы таких систем оказывают влияние несколько факторов, таких как:
- Общая минерализация воды;
- Водородный показатель воды (рН);
- Общие органолептические характеристики воды, такие как цветность и мутность;
- Наличие в воде соединений железа и органики.
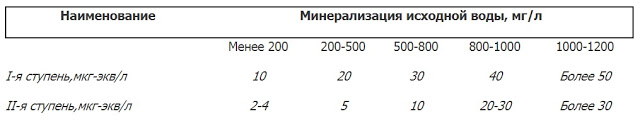
Влияние общей минерализации на эффективность работы системы умягчения
При построении комплексов умягчения воды важно учитывая общую минерализацию исходной воды, а также ее общий ионный состав.
При увеличении минерализации обрабатываемой воды (а увеличение идет, в основном, за счет увеличения содержания в воде натрия), получение глубокоумягченной воды традиционным Na-катионированием (в том числе даже двухступенчатым) становится все более проблематичным.
При проведении процессов умягчения и регенерации следует учитывать действие так называемых противоионов. Противоион – это тот ион, который вытесняется из ионита, то есть в умягчаемой воде ион Na+, а в регенерационном растворе - ионы Са2+, Mg2+
Проблема эффективности протекающих ионообменных процессов вызвана тем, что с ростом концентраций натрия в исходной воде и фильтрате, вступает в силу Закон действующих масс – повышение концентрации в воде иона, содержащегося в катионите (продукта реакции), согласно этому закону, тормозит реакции умягчения воды или регенерации катионита.
Следовательно, чем выше минерализация исходной воды, которая, чаще всего, сопровождается увеличением концентрации ионов натрия, тем больше концентрация ионов натрия в умягченной воде (за счет переноса ионов натрия с матрицы катионита в фильтрат после закрепления на матрице ионита ионов кальция и магния) и, следовательно, выше противоионный эффект, что приводит к увеличению остаточной жесткости фильтрата.
Концентрация противоиона определяется не только начальным содержанием иона натрия в исходной воде, но и тем количеством натрия, которое будет вытеснено из катионита в процессе обмена на ионы жесткости – кальция и магния. Следствием этого становится проскок ионов кальция и магния в фильтрат, что ведет к недостаточной эффективности работы фильтров-умягчителей.
Для достижения требуемых значений жесткости умягченной воды при значениях минерализации исходной воды больше указанных могут быть предусмотрены следующие способы:
- Противоточное натрий-катионирование;
- Двух- и трехступенчатое натрий-катионирование;
- Нагрев исходной воды и регенерационного раствора до температуры, которая допускается конструкцией фильтра и фильтрующим материалом;
- Построение системы умягчения с расчетом линейных скоростей пропускания воды, скорректированной в зависимости от наличия и веса влияющих факторов;
- Использование катионитов, обладающей высокой обменной емкостью.
Расчет линейной скорости фильтрования при построении систем умягчения с применением технологии настий-катионирования
Важно отметить, что объемная скорость фильтрования через слой катионита фильтра в нормальном режиме при построении одноступенчатых систем умягчения воды, принимается в зависимости от общей жесткости исходной воды:
- До 5 мг-экв./л – 20 м/ч;
- 5-10 мг-экв./л – 15 м/ч;
- 10-15 м-экв./л – 10 м/ч.
При выключении одного фильтра на регенерацию в других фильтрах допускается кратковременное увеличение объемной скорости фильтрования на 10 м/ч.
При противоточном натрий-катионировании допустимо увеличивать объемную скорость фильтрования воды через слой катионита до 30-35 м/ч.
Влияние температуры исходной воды на протекание ионообменных процессов
Как и в большинстве химических процессов, повышение температуры исходной воды интенсифицирует диффузию ионов. Поэтому там, где требуется высокая степень умягчения воды, следует производить нагревание исходной воды до 35-40°С, либо до температуры, которую допускает используемое оборудование (фильтры и ионит) умягчения.
Аналогичное условие касается и регенерационного раствора поваренной соли. Тем более что процесс ее растворения является эндотермическим (протекает с поглощением тепла).
Влияние водородного показателя (рН) на эффективность протекания ионного обмена в системах умягчения воды
Значение водородного показателя (рН) исходной воды также влияет на обменную емкость катионита, находящегося в натриевой форме.
Ионы водорода, имеющие сродство к катиониту большее, чем ионы натрия, замещают их в матрице катионита.
В процессе ионного обмена ионы натрия, имеющие большее родство к катиониту, чем ионы Ca2+ и Mg2+, мешают процессу замещения на ионы водорода, т.е. сорбируются катионитом первыми. За счет этого обменная емкость катионита по ионам Ca2+ и Mg2+ снижается.
Таким, образом, чем ниже значение рН (чем больше в исходной воде ионов Н+), тем их большее количество замещает в матрице катионита ионы Na+, а реакция замещения имеет следующий вид:
NaR+ H+ - HR+ Na+
Поэтому, считается, что оптимальное значение водородного показателя рН в процессе Na-катионирования должно быть не менее 6,5 и не более 10,0 (при рН исходной воды долее 10 растет риск разрушения катионита).
Форма выпуска и состав таблетированной соли для смягчения воды
В быту состав применялся уже давно, но если пищевая приправа может слеживаться и образовывать комки, то таблетированная соль для водоподготовки – концентрат с добавками, предотвращающими прессование. Кроме того, обычный порошок хлорида натрия растворяется медленно, с остатком, а технический продукт не оставляет осадка и успешно работает с водой высокой жесткости.
Очищенную таблетированную соль для умягчения воды спрессовывают и формуют в облатки размером с 5-ти рублевую монету. Продается товар в мешках по 25 кг, применяется для приборов бытового назначения, где требуется поступление воды: стиральные, посудомоечные машины, фильтры.
Обратите внимание! Очищенный хлорид натрия для смягчения воды не является пищевым продуктом. Применять состав в кулинарии категорически запрещено
Преимущества таблетированной соли:
- Возможность постепенного, но полного растворения, вне зависимости от степени жесткости воды;
- Эффективность применения при минимальных затратах;
- Высокая скорость процесса умягчения потока жидкости;
- Доступность и удобство применения;
- Экономность. В отличие от сыпучего порошка таблеток требуется в 2 раза меньше, при этом рабочий объем жидкости увеличен;
- Универсальность. Применять соль для фильтрации воды в мешках таблетированную можно в любых емкостях: нагревательных баках, фильтрах, канистрах для отстаивания технической воды;
- Равномерность насыщения. Чистый хлорид натрия обладает эффектом таяния, за счет чего состав равномерно распределяется по всему объему жидкости и не требует перемешивания;
- Отсутствие осадка на рабочей поверхности, что продляет срок эксплуатации оборудования.
Применение таблеток вещества предупреждает образование накипи, способствует вымыванию ионообменной смолы, реагентов из фильтровального оборудования.
Производители таблетированной соли
Выпускается соль таблетированная для водоочистки отечественными и зарубежными производителями. Но далеко не каждый изготовитель предлагает качественный товар правильной очистки.
Пользователи выделяют следующие компании, вызывающие доверие:
- Axal (Германия);
- Broxetten (Нидерланды);
- Универсал СМ (Россия);
- Водекс (Россия).
Немецкие и голландские производители выпускают продукцию с концентрацией 99,9% действующего вещества. Хлорид натрия формуется методом равномерного прессования, за счет чего обеспечивает длительный период очистки. Товар из Нидерландов идеально подходит для бытовых фильтровальных систем, как и соль для фильтров таблетированная от отечественных изготовителей.
Как использовать соль для очистки воды
Использование таблеток – простой и дешевый вариант. Быстрое растворение обеспечивают поры, остающиеся между кристаллами после прессования. Все, что нужно сделать – это заложить таблетку в колбу фильтра и можно подключать умягчительную систему к оборудованию.
Если фильтровальная система отсутствует, хлорид натрия в таблетках засыпается в отдельный отсек стиральной, посудомоечной машины. Расход средства и периодичность применения зависят от объема воды, стандартные нормы указаны на упаковке.
Видео
В сюжете - Какую выбрать таблетированную соль
В сюжете - Обзор сложных фильтров механической очистки
В сюжете - Как устроено производство таблетированной соли
В продолжение темы посмотрите также наш обзор Методы обеззараживания воды разными методами





Спасибо.
ОтветитьУдалитьОчень интересно и познавательно.
ОтветитьУдалить